
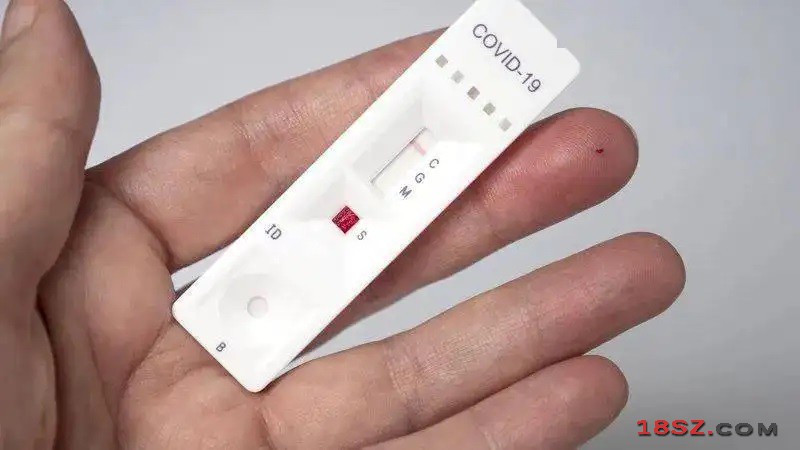
据央视新闻客户端消息,中国国家药监局今天发布通告,批准南京诺唯赞、北京金沃夫、深圳华大因源、广州万孚生物、北京华科泰生物的新冠抗原产品自测应用申请变更。自此五款新冠抗原自测产品正式上市。
根据中国国家药监局政务门户网站发布的最新待领取信息显示,四款新冠抗原检测试剂盒产品获得的医疗器械批准证明文件(变更)待领取,批准时间均在今天(12日),涉及四家公司,包括南京诺唯赞生物科技股份有限公司全资子公司南京诺唯赞医疗科技有限公司、广州万孚生物技术股份有限公司、华大基因子公司深圳华大因源医药科技有限公司、北京金沃夫生物工程科技有限公司。
加上前一天获准变更的北京华科泰,获准变更的厂商已经增至五家。

目前,中国共有五家企业的五款新冠抗原检测产品获批,正是上述五款变更信息的产品。此前,这些产品仅获批用于专业人员使用,而不能自测。
中国国家卫健委昨天宣布,国务院应对新冠疫情联防联控机制综合组决定在核酸检测基础上,增加抗原检测作为补充,并组织制定了《新新冠毒抗原检测应用方案(试行)》。
《方案》规定了抗原检测的适用人群:一是到基层医疗卫生机构就诊,伴有呼吸道、发热等症状且出现症状五天以内的人员;二是隔离观察人员,包括居家隔离观察、密接和次密接、入境隔离观察、封控区和管控区内的人员;三是有抗原自我检测需求的社区居民。
同时,《方案》明确了三类人群进行抗原检测需满足的主要条件、检测试剂的获得渠道,制定了检测发现阳性后的处置管理流程,促进抗原检测与核酸检测相衔接。为便于各地规范开展检测,《方案》还包括两个附件,即基层医疗卫生机构新冠病毒抗原检测基本要求及流程、新冠病毒抗原自测基本要求及流程。

受此消息影响,新冠检测概念股昨天直线拉升,新冠检测指数大涨8.16%。截至昨天收盘,体外诊断指数涨近8%,医药商业指数、肺炎主题指数、医疗器械指数涨幅均居前列。

 天桥起重
天桥起重 HUAWEI
HUAWEI Dahua Technology
Dahua Technology 3M制造业
3M制造业 陕煤化工集团
陕煤化工集团 Gemtique
Gemtique 中国石油
中国石油 延长石油
延长石油 LASTON
LASTON IAA Show
IAA Show PALEXPO
PALEXPO German Machine Tool Builders Association
German Machine Tool Builders Association 中油工程
中油工程 维远光伏产业
维远光伏产业 IFEMA
IFEMA Iteca Exhibitions
Iteca Exhibitions 吉祥星科技
吉祥星科技 陕西有色金属
陕西有色金属 天元化工
天元化工 首匠装饰工程
首匠装饰工程 中杭贸易
中杭贸易 长城润滑油
长城润滑油 PV EXPO
PV EXPO QIIE青岛进博会
QIIE青岛进博会 Expocentre
Expocentre HealthCare
HealthCare KUNVII
KUNVII Hannover Messe
Hannover Messe 大唐旗舰店
大唐旗舰店 Time Out Group
Time Out Group TOSHIBA
TOSHIBA National Media
National Media Dowpol Chemical
Dowpol Chemical MFV Expositions
MFV Expositions Ptak Warsaw Expo
Ptak Warsaw Expo 神木职教中心
神木职教中心 庆祝中华人民共和国成立70周年联欢活动
庆祝中华人民共和国成立70周年联欢活动 云游石博:精品文物之唐三彩陶钵
云游石博:精品文物之唐三彩陶钵 上海健麾信息技术股份有限公司视频介绍
上海健麾信息技术股份有限公司视频介绍 崔培鲁北京工作室创作展示
崔培鲁北京工作室创作展示 西丽综合交通枢纽“顶级设计”方案夺冠
西丽综合交通枢纽“顶级设计”方案夺冠 异形珍珠《水母的舞蹈》视频欣赏
异形珍珠《水母的舞蹈》视频欣赏 路生梅:扎根陕北50载 医者仁心写大爱
路生梅:扎根陕北50载 医者仁心写大爱 苏绣梅兰竹菊等美图欣赏
苏绣梅兰竹菊等美图欣赏 匠心漆韵——金漆镶嵌技艺精品展在京开幕
匠心漆韵——金漆镶嵌技艺精品展在京开幕 宋定窖印花双凤纹碗
宋定窖印花双凤纹碗 美博会-欧式风格
美博会-欧式风格 地中海与古蜀文明跨越时空的多彩对话
地中海与古蜀文明跨越时空的多彩对话 2020年莫斯科国际化工展览会
2020年莫斯科国际化工展览会 南昌出现大雾天气 江面宛如仙境
南昌出现大雾天气 江面宛如仙境 浙江宁波行车行吊销售客户信赖
浙江宁波行车行吊销售客户信赖 2020年欧洲集成系统及技术展览会参展现场
2020年欧洲集成系统及技术展览会参展现场 2023上海国际检验医学及体外诊断试剂展览会
2023上海国际检验医学及体外诊断试剂展览会 安邦云RFM-200-S/210-R 票箱读卡器/天线/读头
安邦云RFM-200-S/210-R 票箱读卡器/天线/读头 2023 年第十二届印度国际塑料工业展览会及会议
2023 年第十二届印度国际塑料工业展览会及会议 2023年泰国国际塑料橡胶展览会
2023年泰国国际塑料橡胶展览会 2026北京国际人工智能展览会(春季展)
2026北京国际人工智能展览会(春季展) 2024年医疗展会|2024上海医博会时间
2024年医疗展会|2024上海医博会时间 CCF2024上海国际日用百货(春季)博览会
CCF2024上海国际日用百货(春季)博览会 DowSyn mPAO150
DowSyn mPAO150 意大利里米尼城市介绍
意大利里米尼城市介绍 纽伦堡 - 玩具都城
纽伦堡 - 玩具都城 慕尼黑 - 伊萨尔河畔的酒都
慕尼黑 - 伊萨尔河畔的酒都 法兰克福 - 欧洲金融中心
法兰克福 - 欧洲金融中心 迪拜 - Dubal
迪拜 - Dubal 俄罗斯 - 战斗民族和套娃的国家
俄罗斯 - 战斗民族和套娃的国家 葡萄牙 - 软木塞之乡
葡萄牙 - 软木塞之乡 西班牙 - 斗牛士的故乡
西班牙 - 斗牛士的故乡




